【线下第二十二期】9月30日《QMSR(质量管理体系法规)介绍》,欢迎报名
【国际医疗器械合规联盟线下分享会】- 第二十二期
9月30日|QMSR(质量管理体系法规)介绍
【活动背景】
2024 年 1 月 31 日,美国食品药品监督管理局(FDA )发布了一项最终规则,根据 21 CFR 820 修订了质量体系 (QS) 法规的器械当前良好生产规范 (CGMP) 要求。 该规则通过引用纳入国际标准化组织(ISO)制定的针对医疗器械质量管理体系的国际标准 ISO 13485:2016 的质量管理体系要求。修订后的第820部分被命名为《质量管理体系法规》(Quality Management System Regulation,简称QMSR)。
那么,QMSR的发展历史如何?与之前的QSR相比,QMSR有哪些改进?修改后的QMSR包含哪些关键要素?近年来,FDA在对医疗器械企业开展飞行检查时,有哪些warning letter ,以及warning letter 的趋势如何?FDA通常会关注哪些方面?企业如何准备以应对这些检查?
龙德推出【国际医疗器械合规联盟线下分享会】系列活动,以服务和帮助中国医疗器械产业,共绘全球医疗健康新篇章!期待您的参与!
【参会对象】
医疗器械生产企业负责人、医疗器械质量管理人员及工程师、医疗器械法规负责人及工程师、医疗器械研发负责人及工程师等。
【主办机构】
龙德医疗器械服务集团
国际医疗器械法规合规联盟
【协办机构】
龙德先进医疗器械质量技术管理研究所
深圳市龙德生物科技有限公司
【参会具体事项】
1.时间:2024年9月30日 09:30-17:00(初拟时间)
2.规模:30人,报满即止。
3.地点:深圳市南山区西丽街道松坪山社区乌石头路8号天明科技大厦16楼会议室
【收费标准】
1.医械云专家平台、医械宝、龙德医课汇会员,参会免费;
2.国际医疗器械法规合规联盟发起单位、会员单位、联盟个人发起人和联盟会员:1个免费名额(企业或个人申请加入国际医疗器械合规联盟可联系龙德医课微信:hlongmed88)
3.其余参会人员600元。
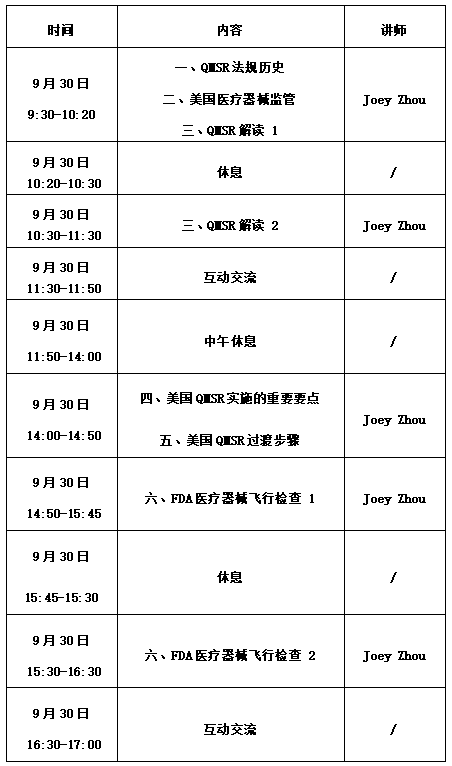
【参会议程】
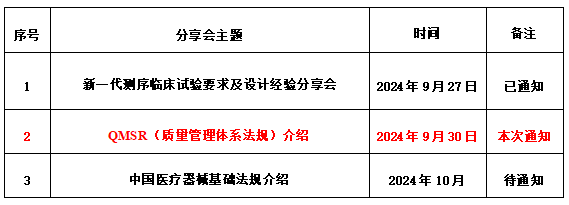
【线下系列活动计划表】
【参会方式】
1.点击下方链接或扫描下方二维码,填写报名表。本次培训报名截止时间为2024年9月29日18:00。名额有限,报满即止。
报名链接:https://docs.qq.com/form/page/DY21wanR0R0RuVE10
报名二维码:

特别说明:①请确保填写信息完整、真实,否则可能无法审核通过;
②9月29日前将以手机短信、微信形式发送确认信息,请密切关注并及时回复确认。
2.活动联系人:
赵女士:13560790058
陈先生:19166267960
【付款方式:网银转账】
其他参会人员,请于9月29日18:00前将费用转账至如下指定银行账户。(缴费时请备注公司或人员姓名)
账户名称: | 深圳市龙德生物科技有限公司 |
账 号: | 7653 5794 2019 |
开户行: | 中国银行股份有限公司深圳东滨路支行 |
【开票信息】
1.缴费后,一周内开具【普通电子发票】,并发送至报名邮箱。
2.请提供发票信息:
1)发票抬头;
2)单位税号;
3)选择发票内容(会务费/咨询费)。
3.发票信息请发送至活动联系人邮箱cjm@hlongmed.com。


