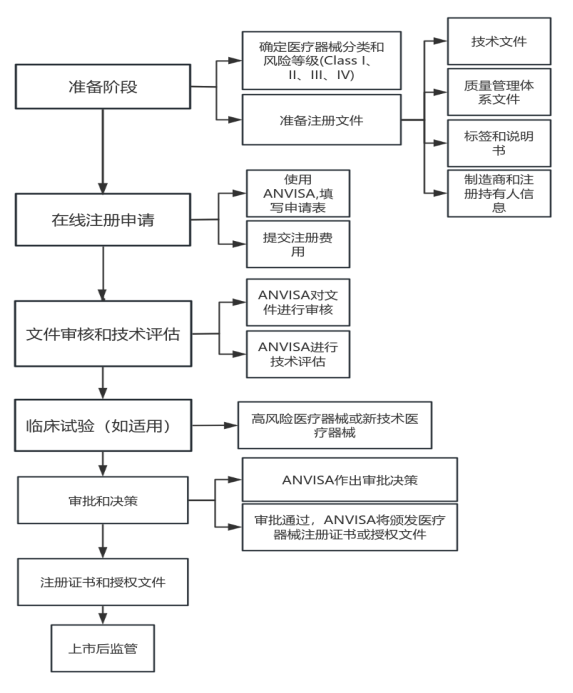
巴西ANVISA注册 巴西国家卫生监管机构(ANVISA):是巴西联邦政府卫生部属下的卫生监管机构,也是巴西医疗器械、化妆品、保健品注册和审批的主要机构,负责批准医疗器械的销售和使用许可,它将用于健康的材料,骨科植入物和体外诊断统称为医疗器械。只有经过注册之后的医疗器械才被允许在巴西销售和使用。医疗器械注册的主要目的是保障患者和医护人员的安全和健康。 1.巴西医疗器械认证分类: (1)I类医疗器械:适用于低风险的医疗设备,如手术手套、口罩等。 (2)II类医疗器械:适用于一定风险的医疗设备,如医用纱布、注射器等。 (3)III类医疗器械:适用于高风险的医疗设备,如人工心脏瓣膜、牙科设备等。 (4)IV类医疗器械:包括假肢、人工关节、听力助听器等高风险医疗设备。 此外,巴西还根据产品的用途将医疗器械分为7个不同的类别: (1)诊断类 (2)治疗和手术类 (3)植入和介入类 (4)体外诊断类 (5)Life support类 (6)康复类 (7)辅助类 2.巴西注册所需文件: (1)医疗器械注册申请表(Cadastro de Produtos para Saude - CPS). (2)制造商/生产者和产品代理商/进口商的授权文件。 (3)产品说明书及标签,其中包括使用说明、成分、功能和性能、原产地、(4)制造和包装日期、保质期、储存条件、交货等信息。 (5)风险评估报告和安全性数据,应包括对可能的损害和或危险性的评估。 (6)生产许可证或生产管理制度证明文件(符合规范要求)。 (7)产品质量保证文档,包括质量保证手册、设备响应记录和生产记录等 (8)临床试验记录和认证,如果适用的话 (9)产品样本(根据审批机构随时要求) (10)其它需要的文件。 注意:以上文件可能需要经公证或翻译后才能使用。 3.适用法规: 法律 No.6.360/1976 - 管理食品、药品、医疗器械和化妆品的规定 法律 No.8.080/1990 - 确立全国卫生制度,协调与完善卫生服务和行动的整合,包括医疗器械。 法律 No.9.782/1999 - 管理国家卫生监管系统。 法律 No.9.883/1999 - 管理医疗器械的工业质量控制。 法律 No.10.742/2003 - 管理卫生系统中医疗器械注册的规定。 此外,巴西国家卫生监管局(ANVISA) 还制定了一系列规定和指南,例如颁布了医疗器械技术规范(RT),安全要求(RS),评价要求和测试(RC),识别标志(RI)等,用于指导和规范医疗器械注册和管理。 4.注册流程: 根据医疗器械的风险等级和用途,医疗器械注册分为不同的类别和程序。一般来说,巴西医疗器械注册的流程如下:
选择注册机构: 申请人需要在巴西国家卫生监管机构(ANVISA)注册的医疗器械注册机构中选择家进行合作。 准备材料:准备医疗器械相关的申请资料,包括产品规格、使用说明、生产许可证等 提交申请: 向注册机构提交医疗器械注册申请包括申请表格和申请资料。 审核和评估: 注册机构会对申请资料进行审核和评估,确保申请符合巴西国家卫生监管机构的要求,并进行必要的测试和评估。这通常包括技术文件的详细审查,以及可能的产品测试和评估。 认证和批准: 如果申请符合要求,注册机构会发放医疗器械认证文件,并提交给ANVISA进行批准,获得ANVISA的批准后,医疗器械才能在巴西销售和使用。 整个医疗器械注册流程需要大约3个月至1年的时间,但具体时间确实取决于多种因素,包括申请人提供的材料的完整性、ANVISA的工作负荷、官方效率以及是否需要进行临床试验等。,更多详细内容,欢迎随时联系龙德相关报价与法规资料。 龙德可协助您完成巴西医疗器械产品注册。如果想具体了解您产品在巴西的注册情况,欢迎联系我们。 |