医疗器械孟加拉DGDA认证,这几步一定要有..... 孟加拉国,一个拥有1.7亿人口的农业和服装业主导的国家,正面临着巨大的医疗器械需求。这个多民族和多宗教的国家,以伊斯兰教为主要宗教,尽管经济欠发达,但其快速增长的医疗行业为国际医疗器械制造商提供了独特的机会。
一、孟加拉市场概览 (1)经济与医疗需求:孟加拉的经济虽然不算富裕,但其庞大的人口基数和对医疗服务的迫切需求,为医疗器械制造商提供了一个不可忽视的市场。特别是对于中国制造的高性价比产品,孟加拉市场有着极高的接受度。(2)市场增长潜力:近几年,孟加拉的医疗行业以较高的年增长率快速发展,其中医疗设备和器械的进口量也在稳步增加,显示出该市场巨大的潜力。(3)中孟贸易关系:孟加拉国是中国在南亚的重要贸易伙伴,尤其在医疗器械领域,中国已经成为其最大的供应商。这种亲近的贸易关系为中国制造商在孟加拉市场上的拓展提供了便利。
二、监管环境 (1)监管机构 :在孟加拉,医疗器械和IVD的监管是由卫生部下属的药品管理局(DGDA) 负责的。这个机构不仅负责注册和批准,还负责监督市场上的医疗器械和设备。(2)注册流程 :制造商在进入孟加拉市场之前,需要通过DGDA的一系列审批程序,包括产品分类、包装批准和注册申请。
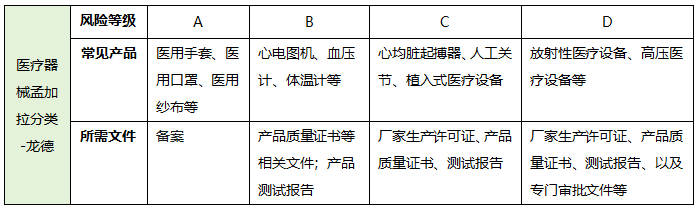
三、产品风险等级分类 A 类器械进行备案, B、C、D 类医疗器械需要注册,B 类器械,须提供原产国出具的自由销售证明,C 类和 D类器械,须提供欧盟、美国、加拿大、澳大利亚和日本任一区域或国家出具的自由销售证明,以及原产国的自由销售证明;必须提交合格评定证书 (CE认证、FDA认证) 或同等证书另外,注册申请时还需要提供生产国和在其他发达国家的监管情况,B类产品需提供原产国出具的自由销售证明(FSC);C类和D类产品,需提供欧盟、美国、加拿大、澳大利亚和日本中任一区域或国家出具的FSC,以及原产国FSC,还必须提交的是合格评定证书或同等资历证书,以及过去2年内因任何原因发生的任何退市或进行召回的详细信息(如有)。
四、注意事项 B、C、D类医疗器械在孟加拉国上市后,生产商或进口商应遵守相关监管要求。严重不良事件应在知晓事件发生后,在指定的时间内向DGDA的指定机构提交分析报告,并应采取适当的纠正和预防措施,以防止或降低不良事件再次发生的可能性。 龙德可协助您完成孟加拉产品注册。如果想具体了解您产品在孟加拉的注册情况,欢迎联系我们。 |