新西兰医械Medsafe 新西兰Medsafe(Medicines and Medical Devices Safety Authority,又称药品和医疗器械安全管理局)是新西兰政府负责监管和管理药品、医疗器械和其他医疗产品的机构。Medsafe负责评估和审批医疗产品的注册、监管医疗产品的质量、安全性和有效性、监督生产和销售等。Medsafe的主要任务是确保新西兰市场上的医疗产品符合国家和国际的标准和要求,保障公众的健康和安全。为此,Medsafe与其他国际医药监管机构保持紧密合作,共同促进医疗产品的安全和可靠性 尽管新西兰不要求医疗器械的上市前批准,但制造商和进口商在将医疗器械引入市场之前必须确保其符合新西兰的法规要求。此外,一旦医疗器械进入市场,制造商或进口商必须在商业化后的30天内将其列入MedSafe的网络辅助器械通知(WAND)数据库。在您的设备被列入 WAND 之前,您必须确保您拥有证明设备安全性和有效性的文件(例如来自欧盟公告机构、加拿大卫生部或美国 FDA 的认证),因为 MedSafe 可能会要求提供此类信息。
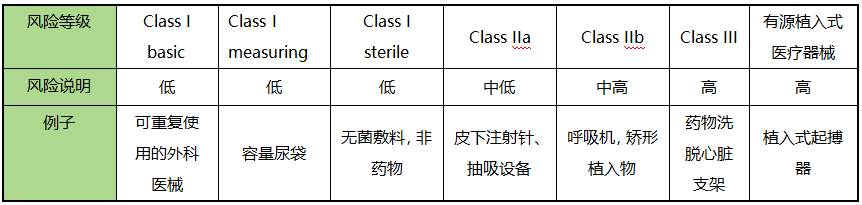
1、Medsafe医械分类: 新西兰使用基于人体风险的分类系统。风险增加分别分配给 I 类(自我认证、无菌或测量)、IIa、IIb、III 和 AIMD。新西兰使用一组规则来确定分类。该系统与欧盟和澳大利亚模式密切相关,并且该系统下的分类将在大多数情况下反映欧盟的分类。
2、注册时间周期: Medsafe在收到所有必要文件和信息后,通常需要6-12个月时间才能审批并注册医疗产品。这个时间可能会因为产品类型、复杂性和其他因素而有所差异。如果需要进行额外的审查或测试,注册可能需要更长的时间(所以在咨询我们知汇产品注册的时候,一定要准备好所需资料才能得出准确的报价周期)。
3、注册流程步骤: 第一步:编制申请: 龙德会为申请人需要准备所有必要的申请材料,包括申请表格、生产和质量控制信息、临床试验结果(如果适用)、标签和说明书等。
第二步:提交申请: 申请人需要将所有申请材料提交给Medsafe进行审核和审批。
第三步:初审: Medsafe会对申请材料进行初步审查,检查申请人提交的资料是否齐全、准确。如果发现缺少或不完整的资料,申请人需要补充或修改相应的信息。
第四步:技术评估: Medsafe将对医疗器械的技术规格、安全性和有效性等方面进行评估。这个过程可能涉及到不同的专业领域,包括医疗器械设计、原理和性能、安全和风险评估、人类工效学等。
第五步:临床评估: 如果医疗器械需要进行临床评估,Medsafe将会审查临床试验方案、结果报告和数据分析,以确定医疗器械的安全性和有效性。
第六步:设计审核: Medsafe将对医疗器械的设计进行审核,确定设计是否合理并符合相关法规和标准。
第七步:授权评估: Medsafe将对医疗器械的授权和技术支持进行评估,以确保设备的供应和服务能够满足需要。
第八步:审批决定: Medsafe将根据所收到的材料和评估结论作出审批决定,可以准予注册、拒绝注册或要求进行进一步的审查和测试
第九步:审批结果: Medsafe将向申请人发出审批结果通知书,说明是否准予注册以及注册许可的条件和限制等信息。
第十步:年检和更新: 一旦医疗器械获得注册许可,申请人需要每年提交更新信息和审查报告,以维持产品的注册状态。同时,Medsafe也会对注册产品进行监督和检查,以确保符合国家和国际的标准和要求。
4、注册所需资料 (1)申请表格:申请人需要填写Medsafe提供的申请表格,表格中包含了申请人的基本信息以及产品的详细描述和用途等。 (2)生产和质量控制信息:申请人需要提交供应链和生产过程的详细信息,包括生产厂商和供应商的资质证书、生产设备和工艺的描述、质量体系和审核报告、药品原材料的采购和控制等。 (3) 药理学和毒理学数据:申请人需要提供产品化学成分和作用机制的证明材料,包括分子结构和特性、药理学和毒理学数据的复印件等。 (4) 临床试验结果:如果产品属于治疗性药品或需要进行临床试验的医疗器械,申请人需要提供临床试验方案和结果报告等材料。 (5)标签和说明书:申请人需要提交产品的标签和说明书的设计和内容,确保其合法、准确、清晰。 (6)其他资料:申请人还需要提供其他相关的数据、信息和证明材料,例如安全性评估、市场情况分析、供应计划等。 龙德可协助您完成新西兰产品注册。如果想具体了解您产品在新西兰的注册情况,欢迎联系我们。 |