医疗器械澳洲TGA认证 澳洲TGA是澳洲卫生部所属的联邦药物主管机构,对药品保健品生产标准最严格。在澳生产销售的营养保健品必须经过TGA批准和监管,其严格程度美国FDA的标准是相当的。 根据澳大利亚医疗用品法(therapeutic goods act 1989)规定,所有在澳大利亚上市的医疗用品(药品和医疗器械)必须按有关要求,向澳大利亚医疗用品管理局(TGA)提出注册或登记申请,获得注册登记(Australian register of therapeutic goods,ARTG)后才能合法上市。
1、申请TGA有什么好处? 澳大利亚是全球少数几个将中药和"保健食品”直接按"药品”注册管理的发达国家之一,也是所有发达国家中程序清晰、标准明确和较易于获得成功注册的国家之一,通过澳大利亚药品注册/登记,可以: ● 获得澳大利亚市场准入和上市许可权利 ● 直接获得发达国家澳大利亚的GMP认证证书 ● 直接获得与澳大利亚有GMP互认(MRA)的多个国家的GMP认可 ● 药品企业可以获得国家有关“获得发达国家注册认证产品优惠政策” ● 注册认证过程将实质性大幅提高企业产品注册与GMP管理水平 ● 注册认证过程将改变和提高企业的国际化理念和认识 ● 大幅提高企业和产品形象及美誉度,极大有利于国内市场营销 ● 保健食品华丽转身为发达国家批准的“药品”,极大有利于国内、国际市场营销 ● 易于获得与澳大利亚有GMP符合确认(CV)关系的多个国家/组织的GMP认可 ● 易于进入与澳大利亚有互认关系及PIC/S成员国的注册和市场准入 ● 易于进入其它英联邦国家的注册和市场准入 ● 东南亚、非洲和拉丁美洲许多国家对澳大利亚上市许可有很高认可度
2、澳洲TGA认证分类 跟国内分类规则不同,澳大利亚是全球少数几个将某些中药和“保健食品”作为治疗用品注册管理的发达国家之一。相较于其他发达国家,澳大利亚在程序的清晰度、标准的明确性和成功注册的可行性方面具有显著优势。通过澳大利亚药品注册/登记,可以实现市场准入。澳大利亚是全世界仅有的将中药和“保健食品”直接按"药品”注册管理的发达国家,也是所有发达国家中程序清晰、标准明确和较易于获得成功注册的发达国家,通过澳大利亚药品注册/登记。澳大利亚TGA根据医疗器械风险等级从低到高,将医疗器械分为Ⅰ类、Ⅱa类、Ⅱb类、Ⅲ类,体外诊断试剂IVD则分为1、2、3、4类。澳洲TGA医疗器械分类(不含IVD)
体外诊断试剂IVD分类
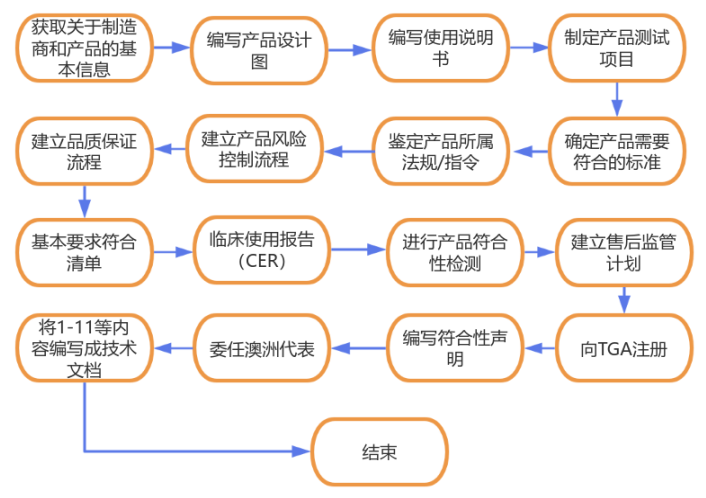
医疗器械TGA注册流程 3、澳洲TGA认证Sponsor Sponsor是代表制造商⾯对TGA的担保⼈。在向澳⼤利亚提供医疗设备之前,Sponsor必须确保(并能够证明)该器械已符合所有适⽤的基本原则,以确保其安全并按预期运作。Sponsor必须拥有该器械的制造商的符合性声明的副本,并能够根据TGA要求将其与其他与该器械相关的文件一起提供给TGA(例如,标签,使⽤说明,广告 材料以及设备性能的证据)。为了支持TGA的上市后监测活动,一旦将器械纳入了ARTG,医疗器械的Sponsor将承担持续的责任。这些法定责任包括发起⼈必须向TGA报告:1. 不良事件2. 澳大利亚海外监管结果3. 制造商自发的调查结果,例如进⼀步的临床研究和不良事件的审查。4. Sponsor还必须从制造商那⾥获得TGA所需的信息,并维护銷售记录。
4、澳大利亚TGA 证书 TGA是澳大利亚药监局的简称,全称是Therapeutic Goods Administration,是监管所有疗效产品(包括:药物、医疗器械、和体外诊断器试剂)的政府机构。任何在澳大利亚售卖的疗效产品必须经过TGA审核和通过,审批通过的疗效产品将列入ARTG名单。ARTG名单是 Australian Register of Therapeutic Goods,通过审核的疗效产品能获得ARTG证书。Q:ARTG证书有编号吗?ARTG Identifier是属于证书的独特编号。 Q:ARTG证书有效期是多久?ARTG注册没有固定的“证书”有效期,以后每年付年费后证书可以持续有效。 Q:ARTG证书上没有我的产品名字,能加上去吗? ARTG注册是针对产品类别的,而不是特定的制造商或产品名称。因此,ARTG注册信息不会突出显示特定的制造商或产品名称
5、快问快答 我已经有欧盟CE标志/已经注册了美国FDA,还需要申请TGA吗?TGA会承认我其他地区的认证吗? TGA认可欧盟、美国、加拿大、日本的法规审核,但所有疗效产品依然需要经过TGA审核和通过。 GMDN是什么? GMDN 是Global Medical Device Nomenclature,是全球医疗器械术语。 龙德可协助您完成澳大利亚产品注册。如果想具体了解您产品在澳大利亚的注册情况,欢迎联系我们。 |