【线下第二十期】9月25日《CRA如何实施医疗器械临床试验项目监查》,欢迎报名!
【国际医疗器械合规联盟线下分享会】- 第二十期
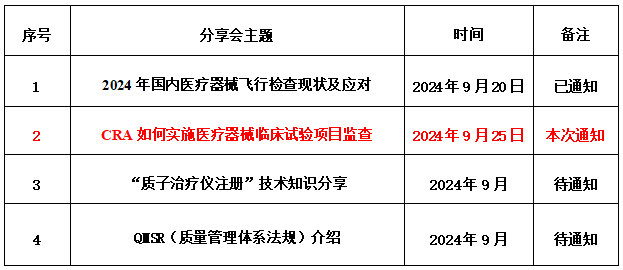
9月25日|CRA如何实施医疗器械临床试验项目监查
【活动背景】
医疗器械临床试验监查是确保临床试验质量和受试者安全的关键环节。其重要性和必要性主要体现在通过监查,可以验证临床试验数据的真实性、准确性和完整性,确保数据的质量。这对于医疗器械的安全性和有效性评价至关重要。且监查过程中,监查员一是会对受试者的知情同意、权益和安全保障进行核查,确保受试者的权益得到保护。二是能够及时发现试验中的问题,如方案违背、不良事件处理不当等,并采取措施予以解决。因此,有效的监查,可以减少试验中的错误和延误,确保试验按计划进行,从而提高临床试验的效率。而且监查结果可为药品监督管理部门提供了监管决策的依据,有助于确保医疗器械的安全性和有效性。确保临床试验的实施符合科学原则和标准操作规程,增强了试验结果的科学性和可信度。
那么,CRA在开展医疗器械临床试验监查前需要做什么准备工作呢?如何开展临床试验监查?怎么识别识别问题及处理呢?
龙德推出【国际医疗器械合规联盟线下分享会】系列活动,以服务和帮助中国医疗器械产业,共绘全球医疗健康新篇章!期待您的参与!
【参会对象】
医疗器械负责人、法规工程师、医疗器械临床管理人员及工程师、监查员以及对医疗器械临床感兴趣的人员、有志于从事临床试验工作的医药专业高校在校大学生。
【主办机构】
龙德医疗器械服务集团
国际医疗器械合规联盟
【协办机构】
龙德先进医疗器械质量技术管理研究所
深圳市龙德生物科技有限公司
【参会具体事项】
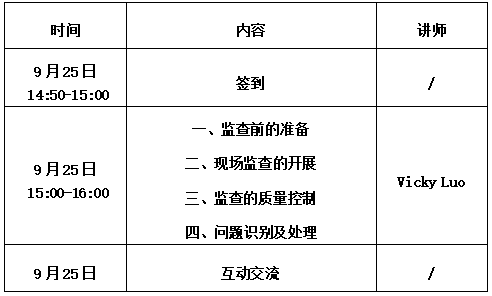
1.时间:2024年9月25日 15:00-16:00(初拟时间)
2.规模:30人,报满即止。
3.地点:深圳市南山区西丽街道松坪山社区乌石头路8号天明科技大厦16楼会议室
【收费标准】
1.医械云专家平台、医械宝、龙德医课直播间,参会免费;
2.国际医疗器械合规联盟发起单位、会员单位、联盟个人发起人和联盟会员:1个免费名额(企业或个人申请加入国际医疗器械合规联盟可联系龙德医课微信:hlongmed88)
3.其余参会人员200元。
【参会议程】
【线下系列活动计划表】
【参会方式】
1.扫描下方二维码,填写报名表。本次培训报名截止时间为2024年9月25日12:00。名额有限,报满即止。
报名二维码:

特别说明:①请确保填写信息完整、真实,否则可能无法审核通过;
②9月20日前将以手机短信、微信形式发送确认信息,请密切关注并及时回复确认。
2.活动联系人:
赵女士:13560790058
陈先生:19166267960
【付款方式:网银转账】
其他参会人员,请于9月25日12:00前将费用转账至如下指定银行账户。(缴费时请备注公司或人员姓名)
账户名称: | 深圳市龙德生物科技有限公司 |
账 号: | 7653 5794 2019 |
开户行: | 中国银行股份有限公司深圳东滨路支行 |
【开票信息】
1.缴费后,一周内开具【普通电子发票】,并发送至报名邮箱。
2.请提供发票信息:
1)发票抬头;
2)单位税号;
3)选择发票内容(会务费/咨询费)。
3.发票信息请发送至活动联系人邮箱cjm@hlongmed.com。


