全球法规注册
龙德医疗器械服务集团
全球法规注册
龙德医疗器械服务集团- 法规咨询
- 国内NMPA认证
- 美国FDA认证
- 菲律宾PFDA认证
- 加拿大HC认证
- 泰国TFDA认证
- 新加坡HSA认证
- 加纳认证




1. 510(k)的由来
510(k)是FDA一个法案里面的一个章节,FD&C法案510(k)章节要求设备制造商至少提前90天通知FDA其销售医疗器械的意图。这被称为上市前通知(Premarket Notification),也称为PMN或510(k)。
2. 510(k)的核心
向FDA提交设备上市前提交文件,证明将要上市的医疗设备实质等同于已合法上市的类似设备。
由此可见,选择合适的对等设备至关重要。
3. 510(k)提交的类型
医疗器械行业的人对510(k)都很熟悉,但是很多人并不知道,同样是提交510(k),但提交的510(k)类型是不一样的。
510(k)有三种提交类型:传统510(k),特殊510(k)和简略510(k)。
3.1 传统510(k)
传统510(k)是最普遍且常见的设备上市注册路径,可用于任何原始510(k)或之前已被FDA 510(k)认可的设备变更。
FDA官方审核周期90天。
3.2 特殊510(k)
在自己现有设备的基础上进行变更的设备上市可考虑选择这种提交类型。
但是需满足两个条件:
1) 评估变更的方法是完善的;
2) 且结果可以以摘要或风险分析方式充分审查。
FDA官方审核周期30天。
注:特殊510(k)通常不适用于在护理点制造生物制品的设备。
3.3 简略510(k)
当设备的提交依赖于以下文件时,可以选择提交简略510(k):
1) FDA指南文件;
2) 符合特殊控制要求;
3) FDA认可的标准。
FDA官方审核周期90天。
4. 510(k)的审核费
所有的510(k)提交类型都需要缴纳审核费,不同510(k)提交类型的审核费都是一样的。
2023财年510(k)审核费:
标准收费:19870美元
小企业优惠收费:4967美元
如果您有产品出口美国,需要开展相关业务,龙德医疗器械服务集团可辅导您提交FDA FDA 510(k),请添加客服微信:hlongmed88,客服帮您找老师开展相关服务!
一、菲律宾医疗器械注册的流程和要求有哪些?
对菲律宾的医疗器械注册流程与标准可能已有更新。 下面所提供的注册流程和要求是基于一般情况的概述,
但鉴于实际情况的变动性,这些信息可能需进一步核实。为了确保您获取的信息准确无误,
我们强烈建议您直接联系菲律宾的食品药品管理局(FDA)或其他相关本地机构,以获取最新且详尽的注册信息。
注册流程:
公司注册:制造商或进口商需要在菲律宾证券交易委员会(SEC)注册公司。本地授权代表:对于国外制造商,必须指定一个在菲律宾的本地授权代表
(Local Authorized Representative, LAR)。
准备文件: 收集并准备所有必要的文件,包括产品注册申请、技术文件、质量管理体系文件、临床试验数据等。
提交注册申请:菲律宾FDA提交完整的注册申请,确保文件齐全、准确,并符合相关法规要求。
初步评估: FDA将对提交的文件进行初步评估,以确保其完整性和符合法规的要求。
如果发现问题,可能需要进行补充材料或信息的提供。
技术评估: 对医疗器械的技术性能和安全性进行详细评估。这可能涉及到对技术文件、
产品规格和测试报告的审查。
质量管理体系审核: FDA可能会审查制造商的质量管理体系文件,以确保其符合国际标准和菲律宾的法规要求。
临床评价(如果适用): 对涉及临床试验的医疗器械,FDA可能要求评估其临床试验数据,
以确保产品的安全性和有效性。
批准或拒绝: 完成所有评估后,FDA将作出批准或拒绝注册的决定。如果获得批准,注册证书将颁发给制造商。
注册要求:
产品注册申请: 提供完整的产品注册申请,包括产品的详细描述、用途、成分、制造过程等信息。技术文件: 提供详细的技术文件,涵盖产品的设计和性能规格、测试报告、标签和说明书等。质量管理体系文件: 提供制造商的质量管理体系文件,确保符合相关的国际标准和法规。临床试验数据(如果适用): 对于需要进行临床试验的医疗器械,提供相关的临床试验数据。费用缴纳: 缴纳与注册相关的费用。
以上是一般性的流程和要求,具体的规定可能会根据医疗器械的类别、风险级别和法规的变化而有所不同。
因此,在开始注册过程之前,建议与菲律宾FDA或当地的注册咨询机构联系,以获取最新的详细信息和指导。
龙德医疗器械服务集团可协助您完成菲律宾医疗器械产品注册,为您提供菲律宾当地代理服务。
如果想具体了解您产品在菲律宾的注册情况,欢迎联系我们。
一、加拿大医疗器械注册及其审批流程
加拿大的医疗器械注册由Health Canada(HC)负责。
主要法规为《Food and Drugs Act》、《Medical Devices Regulations》等。
与大多数国家的情况不同,外国制造商不需要在加拿大拥有当地代理。
加拿大当局将医疗器械根据风险从低到高分为I、II、III和IV类。当局的监管控制水平随风险程度的增加而提高。
加拿大的风险等级分类规定与欧盟类似,但也并不完全相同。
I类产品的海外制造商如果直接销售给加拿大的零售商(retailer),
则该海外制造商需要申请医疗器械机构许可证书(MDEL,Medical Device Establishment License),
费用约为5000加币,时间需要约120天。
但如果I类产品的海外制造商仅销售给进口商(importer)或者经销商(distributor),
且该进口商或经销商已有MDEL证书,则海外制造商无需额外申请MDEL。
II、III和IV类产品的海外制造商则需要申请医疗器械许可证书 (MDL, Medical Device License)
才可以在加拿大进行销售。
另外,这些较高风险产品的制造商也应满足ISO 13485以及加拿大医疗器械法规CMDR对于质量管理体系的要求,
需要拥有加拿大认可的第三方认证机构颁发的证书。当局对技术文件的要求也随风险等级的提升而更严格。
关于费用和时间,它们确实因医疗器械产品的风险等级及具体情况的不同而有所差异。
根据2023年的情况,例如II类的首次注册需要589加币以及约15天;
III类产品需要12987加币以及约75天;IV类产品需要28165加币以及约90天。
在欧盟、美国等地注册过的产品可以缩短总体审查时间。
另外值得注意的是,加拿大当局对于小型制造商企业有费用方面的优惠。
龙德医疗器械服务集团可协助您完成加拿大医疗器械产品注册。
如果想具体了解您产品在加拿大的注册情况,欢迎联系我们。
一、医疗器械泰国Thai FDA注册及其审批途径
泰国,作为东南亚地区医疗器械市场的重要一员,对医疗器械的监管非常严格。这主要由泰国公共卫生部下属的泰国食品和药物管理局(Thai FDA)负责,他们致力于确保所有在泰国市场上销售的医疗器械都符合安全、有效和合规的标准。在医疗器械产品合法引入泰国市场之前,需要在Thai FDA进行注册。
当地的主要法规为Medical Device Act B.E. 2551 (2008)和Medical Device Act (2nd Edition) B.E. 2562 (2019) 等。另外作为东盟ASEAN成员国,泰国也会参考东盟相关法规。
境外制造商首先需要在泰国指定授权当地代理人。注册证有效期为5年,会颁发给该当地代理。一般来说,一个产品在一个时间段内应该只有一个授权代理人。
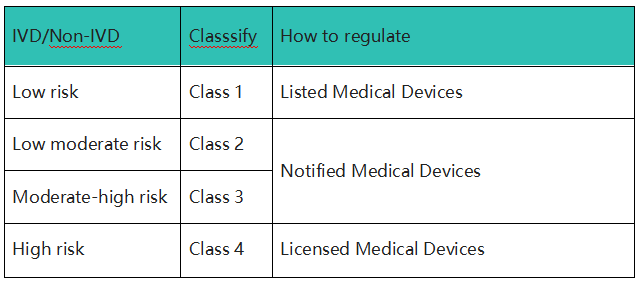
医疗器械(包括IVD)产品的风险分类主要取决于器械的性质和预期用途。在泰国,医疗器械风险等级由低风险向高风险依次分为Class 1, Class 2, Class 3和Class 4四类。
根据风险等级不同,Thai FDA的监管力度也会不同。最低风险的1类产品只需要列名(listing),风险较高的2类和3类产品需要进行通知(Notification),而风险最高的4类产品则需要批准许可(License)。
在泰国主要有三种注册路径:
“简洁路径”(Concise pathway)适用于在参考国家(欧盟、加拿大、日本、澳大利亚、美国或WHO Prequalification)注册过的产品,该产品需要在至少一个参考国家成功注册并上市1年以上,且无严重不良事件。
类似的“信赖计划”(Reliance program)为已在新加坡成功注册的医疗器械提供了在泰国加速注册的便利,但具体要求和适用范围可能会有所不同。
如产品不满足以上两个情况的话,则需要走全流程审批路径(Full evaluation)所有风险等级的产品技术文件均需参考东盟通用提交档案模板CSDT(Common Submission Dossier Template) 。另外对于2、3、4类产品,需要ISO 13485质量管理体系。
根据不同产品风险等级以及产品的具体情况,泰国注册的时间可能需要0-300天。费用也会从几十美元到4000美元不等。
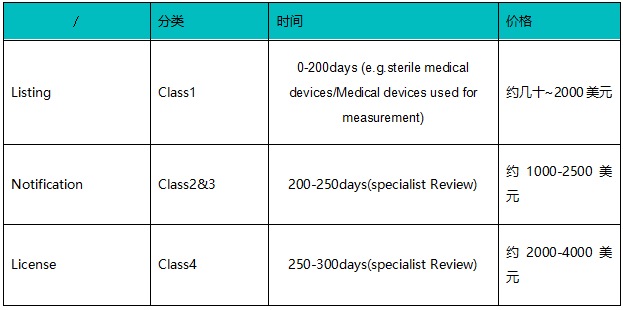
备注:"含无线通信技术:需要额外通过NBTC (National Broadcasting and Telecommunications commission);约30-45工作日/US$200
龙德医疗器械服务集团可协助您完成泰国Thai FDA产品注册,为您提供泰国当地代理服务。如果想具体了解您产品在泰国的注册情况,欢迎联系我们。
一、医疗器械新加坡HSA注册及其审批途径
在新加坡市场销售您的医疗器械产品之前,您需要在新加坡HSA取得产品的注册。
1、简介
新加坡的医疗器械注册由HSA(Health Sciences Authority )相关部门负责。
当地执行的主要法规为《Health Products Act 2007》,《Health Products (Medical Devices) Regulations 2017》等。另外作为东盟ASEAN成员国,新加坡在医疗器械法规方面也会与东盟的相关法规保持一定的协调,但具体的参考程度可能因产品类别和法规更新而有所不同。
首先新加坡以外的生产商需要指定授权在新加坡本地的代理公司作为持证人(License Holder),提交注册文件,与当局沟通 ,以及对上市后等活动负责。
注册申请可以在线通过MEDICS(Medical Device Information and Communication System)进行提交。当局批准后,会列入SMDR(Singapore Medical Device Register)数据库。
2、产品风险等级分类
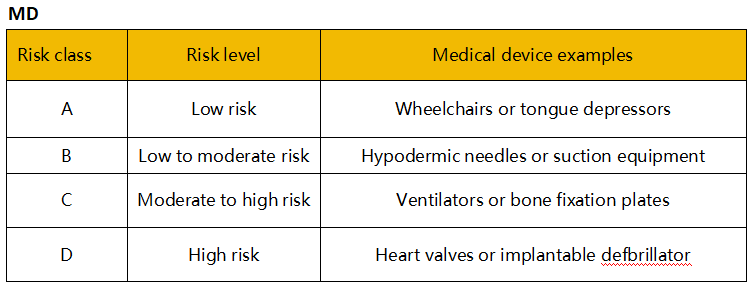
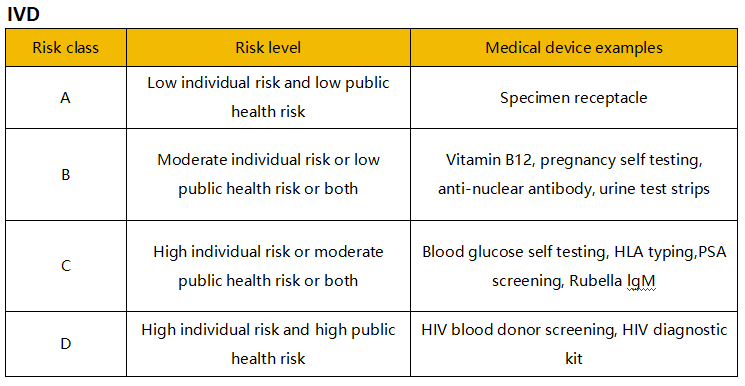
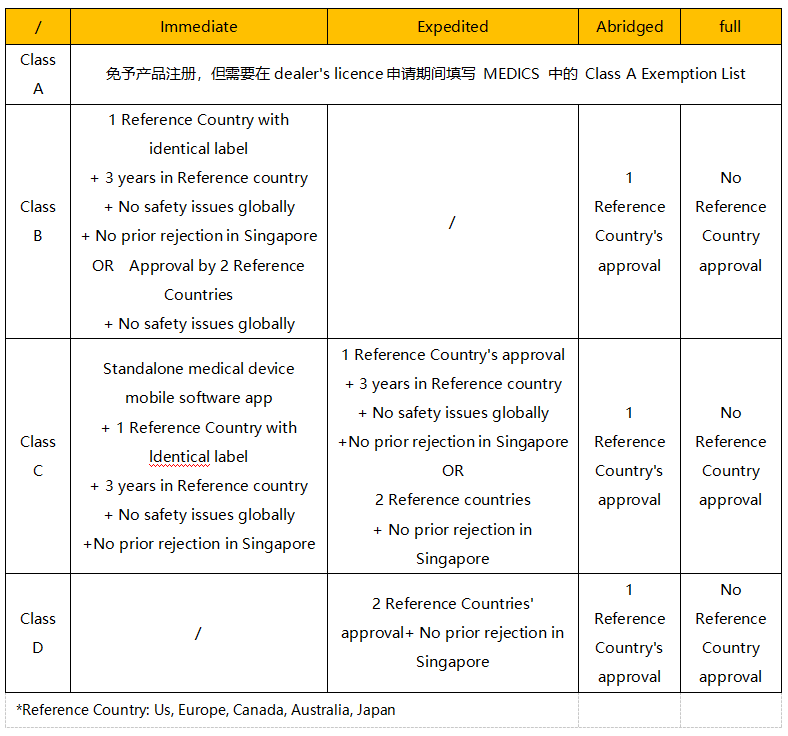
医疗器械的风险分类取决于产品的设计和预期用途。新加坡将医疗器械(包括IVD)根据风险由低至高分为A、B、C、D四类。A类风险最低,D类风险最高。
3、注册路径
新加坡当局认可的参考国家(Reference Country)为美国、加拿大、澳大利亚、日本以及欧盟。
根据产品风险分类以及该产品在参考国家的上市情况,总共有四种不同的注册路径:Immediate、Expedited、Abridged以及Full。总体上来说,同一产品在越多的参考国家获得上市许可,则在新加坡注册的流程越简单快捷。
对于一些创新性产品,在一定条件下新加坡当局也可提供优先个案审核,也会加快约25%的审批时间。
4、技术要求
新加坡当局对于注册技术文件的要求基于东盟ASEAN CSDT(Common Submission Dossier Template),例如符合性声明(Declaration of Conformity)、产品的描述、产品标签、风险分析、临床评价报告(Clinical Evaluation Report)、质量管理体系(QMS)相关文件等。不同风险分类(如A、B、C、D类)和不同注册路径(如Immediate、Expedited、Abridged、Full)所需的技术文件确实不同。
对于质量管理体系,新加坡当局可以接受ISO13485、MDSAP、美国当局的审核(Conformity to US FDA Quality System Regulation)、或日本当局的审核(Japan MHLW Ordinance 169)。
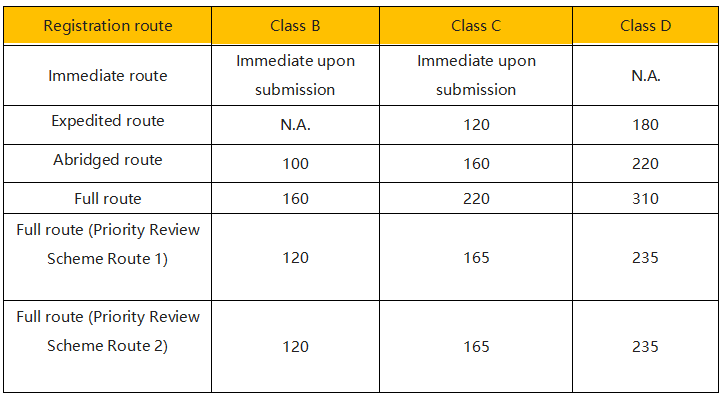
5、官方审批时间
不同分类及不同注册路径所需要的时间及费用不同。例如A类产品可以免予注册,时间最短、费用也最低。而对于高风险产品,注册时间可能需要200-300天,官方费用根据注册的路径不同大约需要1-2万美元。
同一生产商的相同产品、或需要共同使用的产品,可以以Grouping形式提交注册,从而来节约时间和费用成本。
龙德医疗器械服务集团可协助您完成HSA产品注册,为您提供新加坡当地代理服务。如果想具体了解您产品在新加坡的注册情况,欢迎联系我们。
加纳医疗器械注册

根据加纳食品和药品管理局(Ghana FDA)发布的《医疗器械注册指南》,Ghana FDA对医疗器械的注册要求主要概括为一般要求和具体要求这两个方面。
A.一般要求
1.封面信
2.申请人
3.当地代理人
4.申请分类
n新的注册申请
n注册续期的申请
n已注册医疗器械的变更申请
5.语言和数据呈现
6.评估流程
n先来先审评
n加快申请条件
7.cGMP和QMS的验证
8.申请结果
B. 具体要求
1.制造商的义务
2.避孕套
3.诊断检测试剂盒
A.其中对一般要求的具体规定是:
1.关于封面信的要求
所有医疗器械注册申请均应提交封面信和填妥的申请表。
2.关于申请人的要求
需要由医疗器械制造商或进口商提出注册申请,因为他们要对产品以及与产品相关的所有问题负责,包括产品附带的任何信息,对于非加纳申请人,需要指定一名具有必要授权的当地代理人来代表该申请人。
3.关于当地代理人的要求
在加纳注册的法人团体,具有申请人的相关授权,代表申请人行事与加纳医疗器械注册有关的事宜。
除其他事项外,当地代理人将:
n监控市场上的器械,并适当地向FDA通报与注册器械有关的任何相关问题,包括可能危及患者、操作者或任何其他人的安全和/或健康或公共卫生的任何严重制造缺陷。
n促进申请人与FDA之间就产品相关事宜进行沟通。
n处理器械召回。
n为注册器械的用户提供技术支持和服务。
4.关于申请分类,主要分为
4.1新的注册申请
4.2注册续期的申请
4.3已注册医疗器械的变更申请
4.1新的注册申请
n定义:将医疗器械首次投放到加纳市场,每个单一医疗器械、医疗器械组、医疗器械系列或医疗器械系统都需要单独申请。
n新的注册申请应包括:
4.1.1一份原始硬拷贝和一份采用文本可选择的便携式文档格式 (PDF) 的电子副本,存在只读光盘上。
4.1.2根据 FDA 样品计划提供产品样品。
4.1.3根据 FDA 费用表,医疗器械注册申请费不可退还。
4.2注册续期的申请
应在现有注册到期前至少 3 个月提出,并提交以下材料:
4.2.1填写完整的续期注册申请表。
4.2.2根据 FDA 样品计划提供产品样品。
4.2.3 根据FDA费用表,医疗器械注册申请费不予退还。
4.3已注册医疗器械的变更申请
任何对注册产品的变更申请均应按照《医疗器械注册指南》的所有适用要求提出。
此类申请应说明可合理预期会影响注册产品的安全性、质量或良好性能的任何重大变化。重大变化可能包括但不限于以下任何一项:
4.3.1制造工艺、设施或设备;
4.3.2制造质量控制程序,包括方法、测试或用于控制器械或制造材料的质量、纯度、安全性和无菌性的程序;
4.3.3器械的设计,包括其性能特征、工作原理以及材料、能源、软件或配件的规格;和
4.3.4器械的预期用途,包括任何新的或扩展的用途、器械禁忌症的任何添加或删除,以及用于确定其到期日期的期限的任何变化。
5.语言和数据呈现
n英文,不接受仅以英文以外的语言提交的报告
n非英文,原文副本和完整的英文译文(需由在最近的加纳大使馆或文件来源国的国家药品监管局进行翻译件的认证)
n字体:不小于12号,并应以 A4 和 80g/m2纸呈现
n页数按顺序编号,格式页码为第x页(y页),并附有“目录”,注明申请表相关部分的章节和页码。
n在适用的情况下,首字母缩略词和缩写词应在每个部分首次使用时定义。
n卷宗应装订牢固,并按顺序排列,并可针对不同部分分别装订成册,但应按顺序编号(例如第 1 卷,共 2 卷),以便于参考。
6.关于评估流程
前提:收到纸质文件和电子副本(文档内容的摘要)、样本和费用。
FDA 只有在支付申请费后才会收到申请。
6.1一般来说,申请的评估将按照先来先审评 (FIFO) 的原则进行。
6.2加快申请条件
产品用于以下用途,则可以加快申请
6.2.1公共卫生计划
包括艾滋病毒/艾滋病、疟疾、结核,生殖健康、被忽视的热带疾病,例如:布鲁里溃疡,以及 FDA可能不时确定的任何其他疾病状况。
6.2.2儿科项目
6.2.3仅用于卫生部招标目的
6.2.4批准后变更
6.2.5注册续期
7.cGMP和QMS的验证
验证是否符合现行良好生产规范 (cGMP) 和质量管理体系 (QMS)
n如果新申请来自新的生产场地,FDA 将在产品注册之前对该设施进行检查或使用其他方式验证该设施是否符合 cGMP 法规和/或指南。
n除非工厂符合 cGMP,否则不得注册任何产品。
ncGMP 检查报告将构成注册过程的一部分。
8.申请结果(有三种,批准、拒绝或推迟申请)
产品注册委员会对申请进行审查。
n涉及申请的所有文件,包括标签审查报告、档案评估报告、实验室分析报告和 GMP 状态报告,将提交给药品注册委员会审查并最终确定申请的状态。
n如果委员会决定存在安全、质量或性能问题需要解决,则可以推迟申请,等待问题解决。
注意:申请人在十二个月内未能提供所需资料的,将被视为申请人撤回申请。此后,只有在提交新申请后才能考虑产品注册。
B.对具体要求的具体规定是:
1.制造商的义务
1.1制造商应当保证医疗器械符合安全性、有效性的要求。
1.2制造商应保留客观证据来证明医疗器械满足这些要求。
医疗器械必须安全、有效,并且在符合现行良好生产规范 (cGMP) 的场所制造。
Ø制造商需提供产品的技术文档,包括:
²器械描述及特点
²符合基本原则的证据
²材料
²器械规格
²器械验证和确认
²生物相容性(如适用)
²软件验证和确认(如适用)
²含有生物材料的器械(如适用)
²临床前研究(如适用)
²临床证据(如适用)
²风险分析
²制造信息
Ø制造商在提供标签时,需满足以下要求:
标签是英文,并以清晰、永久、显着的方式表达,并易于被预期使用者理解。
1)标签信息包括:
(a)器械的名称,“专有”和“通用”。
(b)制造商的名称和地址
(c)生产基地地址
(d)器械的标识符,包括属于系统、测试套件、医疗器械组、医疗器械系列或医疗器械组系列的器械的标识符
(e)如果是 III 类或 IV 类器械,则为控制编号,否则为批次或批号
(f)以适合器械的术语表达包装内容,例如尺寸、净重、长度、体积或单位数量
(g)如果制造商打算在无菌条件下销售器械,则显示“Sterile”一词
(h)如果器械仅供一次性使用,则应注明“for single use only”
(i) 以日、月和年表示器械的有效期
(j)制造、销售或代表器械的医疗条件、目的和用途,包括器械的性能规格(如果这些规格对于正确使用是必要的,除非对预期用户来说是不言而喻的)
(f) 使用说明,除非安全有效地使用该器械不需要说明。
(k)产品的警告、注意事项和限制
(l)适用于器械的任何特殊存储条件
(j) 标签设计不得与FDA已注册的其他产品极为相似
2)其他:
a)除上述要求外,如果该器械面向公众销售,则标签信息应列于包含该器械的包装外部,并且必须在正常销售条件下可见;
b)如果包含器械的包装太小,无法显示上述规定的所有信息,则应随附器械的使用说明,但无需在包装外部列出,也无需在正常销售条件下可见。
3)必须提供相关适用标准要求的任何特殊信息
Ø关于器械详细信息,制造商需提供
1)名称:说明器械的通用名称和品牌名称。
2)描述:应说明器械的设计、特性和性能的一般描述。这应包括器械包装的相关信息。
3)类别:如果适用,请提供器械的 GMDN 类别。否则,请明确任何其他适用的代码。
4)预期用途/适应症:说明器械的预期用途和/或提供器械将诊断、治疗、预防、治愈或减轻的疾病或病症的一般描述。还应包括该器械的目标患者群体的描述。
5)使用说明:应提供安全使用器械的信息摘要,包括程序、方法、频率、持续时间、数量和应遵循的准备工作。
6)禁忌症:在这些情况下不应使用该器械。
7)警告:提供用户在使用器械之前需要了解的具体危险警报信息。
8)注意事项:简要说明安全有效使用器械所需采取的预防措施和任何必要的特殊注意事项。
9)不良影响:指定在正常使用条件下与器械相关的所有不良反应和副作用。
10)替代用途:提供(如果有)替代实践或程序来诊断、治疗、治愈或减轻该器械所针对的疾病或病症。
11)储存条件:说明器械的储存条件。
12)建议的货架期(如适用):说明器械的建议货架期
2.关于在加纳注册避孕套,需特别注意,
2.1避孕套注册时要求提交1600只样品,这需要在申报材料中提供了分析证书(COAs)的批次中抽样。
2.2注册后,任何进口的避孕套货物都将被扣留、抽样和分析。抽样是按批次进行的。只有通过 FDA 医疗器械实验室进行的质量评估,货物才会放行。
2.3对于所有进口避孕套,FDA 将对生产设施进行强制性国外检查,以确定该设施是否符合 cGMP 和/或 QMS 法规。
3.关于诊断检测试剂盒
3.1提供原材料生产过程的详细信息:
(a) 原材料的控制
(b) 材料来源——蛋白质等。
(c)制造和纯化方法
(d)表征
(e)规格和分析证书
(f)质量控制
3.2成品制造流程
(a)发布规范
(b)货架期规格
3.3成品
(a)特异性
(b)灵敏度
(c)准确性
(d)稳定性-货架期的合理性
龙德医疗器械服务集团可协助您完成加纳医疗器械产品注册,为您提供加纳当地代理服务。如果想具体了解您产品在加纳的注册情况,欢迎联系我们。


